Во многих учебных пособиях для учащихся средних школ приводится схема
простейшей генетической связи между классами неорганических веществ, в
результате чего в каждом случае продуктом реакции является соль:
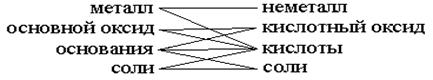
Таким образом, в этой графической схеме указаны 9 методов получения
солей, но если присмотреться внимательно, она может служить учащимся
экскурсоводом в химические свойства неорганических соединений. Так,
например, кислоты обладают следующими свойствами:
- 1) взаимодействие с металлами;
- 2) взаимодействие с основными оксидами;
- 3) взаимодействия с основаниями;
- 4) взаимодействие с солями.
Металлам соответствуют основные оксиды, неметаллам - кислотные оксиды.
Основным оксидам соответствуют основания, кислотным оксидам - кислоты.
Основаниям и кислотам соответствуют соли. Это общие свойства. При
рассмотрении же каждого класса соединений необходимо рассматривать и
частные случаи. Так, например, отношение металлов к кислотам.
Абитуриенты часто упускают из вида особенности реакции взаимодействия
кислот с металлами и таблицу электрохимического ряда напряжения
металлов. Им должно быть известно, что концентрированная серная кислота
взаимодействует со всеми металлами. Кроме платины и золота. При этом
образуется сульфат металла, выделяется оксид серы (IV) и вода. С
активными металлами, такими как цинк, магний, в зависимости от
концентрации кислоты, совместно с оксидом серы (IV) может выделяться
сероводород либо выпасть в осадок сера. Например:
Ag + 2H2SO4 = AgSO4 + SO2↑ + 2H2O
Zn + 2H2SO4 = ZnSO4 + SO2 ↑+ H2O
3Zn + 4H2SO4 = 3ZnSO4 + S↓ + 4H2O
Zn + 5H2SO4 = 4ZnSO4 + H2S↑ + 4H2O
Концентрированная серная кислота не взаимодействует с алюминием, железом
и хромом. Это объясняется тем, что на поверхности металлов образуется
пассивная оксидная пленка, предотвращающая дальнейшее взаимодействие
металла с кислотой:
9H2SO4 + 4Al = Al2(SO4)3 + Al2O3 + 6SO2 ↑ + 9H2O
Разбавленная серная кислота взаимодействует только с металлами, которые в
электрохимическом ряду напряжений металлов стоят до водорода. При этом
образуется сульфат металла и выделяется водород. Например:
Zn + H2SO4 = ZnSO4 + H2↑
Cu + H2SO4 ≠ (не взаимодействует).
Концентрированная азотная кислота при взаимодействии с металлами,
стоящими в электрохимическом ряду напряжений металлов после водорода
(кроме благородных металлов, таких как золото, платина), образует нитрат
металла, выделяется оксид азота (IV) и вода:
Cu + 4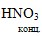 HNO3 = 4Ca (NO3)2 + N2O + 5H2O
HNO3 = 4Ca (NO3)2 + N2O + 5H2O
При взаимодействии концентрированной азотной кислоты с
щелочными и щелочноземельными металлами продуктами реакции являются
нитрат металла, оксид азота (I) и вода:
4Ca + 10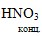 = 4Ca(NO3)2 +N2O + 5H2O
= 4Ca(NO3)2 +N2O + 5H2O
Концентрированная азотная кислота, так же как и
концентрированная серная кислота, пассивирует поверхность железа,
алюминия и хрома, поэтому она на эти металлы не действует. Так, при
пассивации поверхности алюминия концентрированной азотной кислотой, в
первый момент реакция протекает по уравнению:
2Al + 6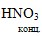 = 6NO2 +Al2O3 + 3H2O
= 6NO2 +Al2O3 + 3H2O
В продуктах реакции может быть также нитрат алюминия:
3Al + 12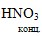 = Al(NO3)3 +Al2O3 + 9NO2 + 6H2O
= Al(NO3)3 +Al2O3 + 9NO2 + 6H2O
Разбавленная азотная кислота при взаимодействии с металлами, стоящими в
электрохимическом ряду напряжений металлов после водорода, образует
нитрат металла, воду и выделяется оксид азота (II). При этом надо иметь в
виду, что разбавленная азотная кислота, так же как и концентрированная,
с благородными металлами Au, Pt, Rh, Ir, Ta не взаимодействует.
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O
При взаимодействии разбавленной азотной кислота с щелочными и
щелочноземельными металлами, а так же оловом и железом образуется
аммиак, который связывается с избытком азотной кислоты в виде соли
нитрата аммония:
4Ca + 10 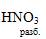 = 4Ca(NO3)2 + NH4NO3 + 3H2O
= 4Ca(NO3)2 + NH4NO3 + 3H2O
При взаимодействии разбавленной азотной кислоты с металлами водород не
выделяется. Исключение составляет только магний. В результате реакции
взаимодействия разбавленной кислоты с магнием маряду с аммиаком
выделяется так же и водород:
4Mg + 10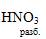 = 4Mg(NO3)2 + NH4NO3 + 3H2O
= 4Mg(NO3)2 + NH4NO3 + 3H2O
Mg + 2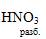 = Mg(NO3)2 + H2
= Mg(NO3)2 + H2
Азотная и серная кислоты являются сильными окислителями, чего нельзя
сказать о соляной кислоте. Поэтому концентрация соляной кислоты не имеет
влияния на образование продуктов реакции, т. е. если протекание реакции
возможно, независимо от того, разбавленная или концентрированная
кислота,- продукты реакции одни и те же. Концентрация кислоты влияет
лишь на протекание скорости реакции.
В связи с тем, что соляная кислота - слабый окислитель, она с металлами,
стоящими в ряду напряжения металлов после водорода, не взаимодействует
(подобно разбавленной серной кислоте).
В соответствии с вышеописанным предлагается самостоятельно решить следующую задачу.
Задача 17 В каком из приведенных случаев кислота практически не оказывает действия на металл:
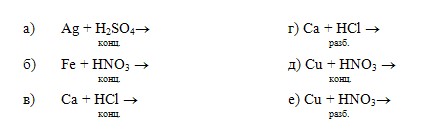
Абитуриент должен знать, что металлы классифицируются на типичные и
амфотерные. К типичным металлам относятся металлы основных подгрупп I и
II групп ПСХЭ (кроме Be), Cu, Ag, Cd, Hg, Ln, Tl, La (лантаноиды), Ac
(актиноиды), Ni, новые синтезируемые радиоактивные элементы, такие как
Db (дубний), Jl (жолиотий), Rf (резерфордий), Bh (борий), Hn (гений), Mt
(мейтнерий) и др. Остальные металлы - амфотерные.
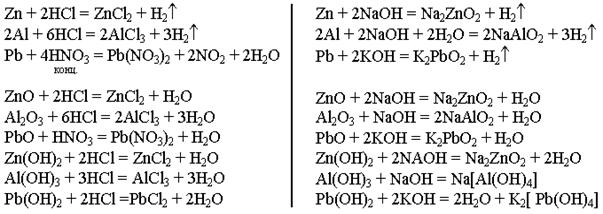
Типичные металлы, а так же их оксиды и гидроксиды взаимодействуют с кислотами, но с основаниями не реагируют.
Амфотерные металлы вступают во взаимодействие как с кислотами, так и с
основаниями. Некоторые абитуриенты представляют реакцию взаимодействия
амфотерных металлов с основаниями как реакцию замещения. Они пишут
уравнения реакций:
Al + 3NaOH = Al(OH)3 + 3NA
Cd + 2KOH = Cd(OH)2 + 2K/
Однако напишем правильные уравнения реакций на примере трех металлов - цинка, алюминия и свинца:
Щелочные и щелочноземельные металлы, а также их оксиды взаимодействуют с
водой. Остальные металлы и их оксиды с водой не
взаимодействуют.
2 Na + 2H2O = 2NaOH + H2 ↑
Ca + 2H2O = Ca(OH)2 + H2 ↑
Na2O + H2O = 2NaOH
CaO + H2O = Ca(OH)2
Абитуриенты часто от волнения допускают такие ошибки в дописании уравнений реакций, как, например,
Cu + H2O = Cu(OH)2 + H2 ↑
Fe + H2O = Fe(OH)3 + H2 ↑
Правильная запись приведенных уравнений:
Cu + H2O ≠ не взаимодействует
Fe + H2O ≠ не взаимодействует
При проверке знаний абитуриенты, как правило, проявляют хорошую
подготовленность по химическим свойствам отдельных классов
неорганических соединений. Однако при выполнении заданий по
осуществлению цепочки превращений у них не хватает аналитической
практики. Так, например,
Задача 18 Осуществить следующую цепочку превращений:
CuSO4  CuCl2
CuCl2  AlCl3
AlCl3  MgCl2
MgCl2  Mg(NO3)2
Mg(NO3)2  Mg(OH)2
Mg(OH)2
 H2O
H2O NaOH
NaOH  H2
H2  H2O
H2O H2SO4
H2SO4  CuSO4
CuSO4 CuS
CuS
Наиболее часто допускаются ошибки при осуществлении 1,2,4 и 8 стадий превращения.
Необходимо помнить, что реакция считается проведенной до конца, если продуктами реакции являются:
а) осадок (нерастворимое вещество)
б) газы;
в) вода.
Поэтому ответ, который часто выбирают абитуриенты, является неверным; например:
CuSO4 + 2HCl → CuCl2 + H2SO4
Кислотный остаток 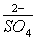 можно осадить ионами Ba2+. Таким образом, правильным ответом будет решение:
можно осадить ионами Ba2+. Таким образом, правильным ответом будет решение:
CuSO4 + BaCl2 → BaSO4↓ + CuCl2
Для перехода от CuCl2 к AlCl3 возможно взаимодействие CuCl2 с Al2(SO4)3, Al(NO3)3 либо Al. Правильный ответ:
3CuCl2 + 2Al → 3Cu + 2AlCl3
Находятся студенты, которые осуществляют реакцию с несуществующими солями Al2(CO3)3 или Al2S3. Поэтому для выбора реагентов необходимо пользоваться таблицей растворимости кислот, оснований и солей в воде.
Для перехода от MgCl2 к соли Mg(NO3)2 большинство абитуриентов отдают предпочтение HNO3,
хотя протекание такой реакции не возможно. Прибегая к помощи таблицы
растворимости кислот, оснований и солей в воде, видно, что реакцию можно
осуществить с помощью AgNO3 или Pb(NO3)2. Поскольку при образовании PbCl2
образуется малорастворимое соединение, а AgCl - нерастворимое, то
предпочтительнее брать реагентом для качественной реакции на ионы хлора
AgNO3:
MgCl2 + 2AgNO3 = Mg(NO3)2 + 2AgCl↓
При осуществлении превращения 8 необходимо вспомнить взаимодействие
щелочей с амфотерными металлами, например, цинком, алюминием. Тогда:
2NaOH + 2Al + 2H2O = 2NaAlO2 + 3H2 ↑

