Наследственность, гены, ДНК... Кажется, эти слова уже давно перестали
быть научными терминами, вошли в повседневную жизнь и знакомы теперь
каждому старшекласснику, не говоря уже о студентах. Но никакой ДНК
большинство из нас никогда не видело, хотя увидеть её — дело вполне
реальное даже в домашних условиях. В одной из генетических лабораторий
на стене висит, к примеру, вот такая инструкция:
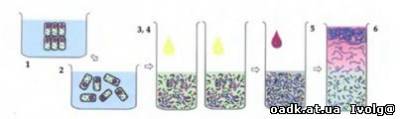
Как самому выделить ДНК
1. Найдите что-то, что содержит много ДНК. Например, зелёный горошек (но можно куриную печенку, селёдочные молоки или лук).
2.
Положите в миксер около 100 мл (полстакана) этого продукта, добавьте
1/8 чайной ложки соли и 200 мл (стакан) холодной воды. Взбивайте в
течение 15 секунд. Миксер «сварит» вам горохово-клеточный суп.
3.
Процедите смесь через ситечко или кусок капрона (чулок вполне
подойдет). В полученную мякоть добавьте 1/6 от её количества (это будет
примерно 2 столовые ложки) жидкого моющего средства (для посуды,
например) и хорошо размешайте. Оставьте на 5-10 минут .
4. Разлейте жидкость по пробиркам или другим стеклянным посудинам, чтобы в каждой было заполнено не больше трети объёма.
5.
Добавьте в каждую пробирку по чуть-чуть либо сока, выжатого из
ананаса, либо раствора для контактных линз и осторожно встряхните,
переворачивая и наклоняя пробирку (если будете трясти слишком рьяно,
разломаете ДНК и ничего не увидите).
6. Наклоните
пробирку и медленно влейте в неё немного этилового спирта, чтобы он
образовал слой поверх гороховой смеси. Лейте, пока спирта и смеси не
окажется поровну. ДНК всплывёт наверх в виде хлопьев.
7. Деревянной палочкой (карандашом) выловите их и рассмотрите под микроскопом.
Конечно,
для научных работников эта инструкция — в какой-то степени шутка и
никто из них ДНК таким способом не выделяет, а между тем если и вправду
воспользоваться ею, то всё получится! Выход ДНК будет, правда, невелик, а
вещество — не особенно чистым, но увидеть в микроскоп длинные тонкие
нити — кристаллы ДНК — вполне возможно.
Что же происходит с зелёным
горошком или куриной печёнкой в процессе описанных манипуляций и почему,
в конечном счете, ДНК оказывается отделённой от всех остальных веществ,
которых в клетке великое множество?
1. Выбор объекта
ДНК, как известно, есть в каждой клетке,
а значит, выделить её можно из любой ткани — даже из костей животных,
чешуи рыб или древесины, где клеток не так уж много по сравнению с
объёмом внеклеточного вещества.
Во всех тканях организма, как
животного, так и растения, ДНК, как правило, одинакова. Отличаются эти
ткани тем, что в одних из них помимо вещества наследственности больше
почти ничего нет (молоки селёдки), а в других, таких, как костная ткань,
содержание ДНК относительно невелико. Кроме того, существуют ткани, в
клетках которых имеется удвоенный набор хромосом (к тетраплоид- ным
относятся, в частности, клетки печени) , а потому и ДНК в них в два раза
больше, чем во всех остальных. В семенах растений относительное,
содержание ДНК выше, чем в стебле, а из молодых растущих побегов её
можно выделить существенно больше, чем из такого же по объёму куска
одревесневшего ствола.
В общем, если перед исследователем не стоит
какой-то специальной задачи, он старается выбрать для работы ткань, в
которой мало межклеточного вещества и много самих клеток. Причём
желательно, чтобы ткань легко распадалась на эти составляющие, а клетки
не были перегружены белками (как мышечные), липидами (как жировые) или
полисахаридами (как клетки мозга).
2. Дробим ткань на клетки
В миксере ткань, из которой мы
собираемся добыть вещество наследственности, распадается на отдельные
клетки: чтобы механически разорвать связи между ними требуется, как
правило, гораздо меньше усилий, чем для того, чтобы повредить саму
клетку. И поскольку при нашем способе выделения ДНК требуются более или
менее целые, неповреждённые клетки, ясно, что консервированный горошек
или солёная селёдка для такого эксперимента не годятся, — лучше уж взять
что- нибудь свежезамороженное, если вы уверены, что продукт не
размораживали в процессе хранения несколько раз.
А немного соли нужно
добавить в раствор для того, чтобы клетки не полопались раньше времени:
давление внутреннего содержимого на клеточную мембрану изнутри
уравновешивают давлением соляного раствора снаружи.
3. Высвобождаем макромолекулу
Что касается фильтрации, то она нужна
для того, чтобы механически удалить из клеточной суспензии всевозможные
примеси, в том числе, крупные куски ткани — всё равно те вещества,
которыми мы собираемся обрабатывать смесь, не смогут проникнуть глубоко
внутрь таких конгломератов, и для выделения ДНК они окажутся
бесполезными.
А обработать полученные клетки следует, в первую
очередь, каким-нибудь детергентом. Средство „Ферри", способное, согласно
рекламе, легко отмыть самую жирную посуду, годится и для того, чтобы
наделать больших дырок в липидной мембране, как самой клетки, так и её
ядра. Если нет жидкого моющего средства, можно сделать концентрированный
раствор стирального порошка — тоже подойдет.
В результате такой
обработки всё клеточное содержимое вывалится наружу и окажется в
растворе, который сделается при этом очень вязким, тягучим и существенно
более прозрачным, чем была клеточная суспензия. Изменение консистенции
раствора — верный знак того, что лизис прошёл успешно.
4. Тут всё ясно и без комментариев
Не наливайте слишком много раствора в
ёмкость, туда предстоит ещё много чего налить, к тому же, если смеси
будет в избытке, её будет трудно перемешать.
5. Освобождаемся от белков
Чего только нет в нашей смеси! Однако
белков здесь — больше всего, причём именно они образуют самые прочные
комплексы с ДНК. Существуют методики, когда белки удаляют из раствора, в
несколько этапов. Например, часть из них легко денатурирует и выпадает в
осадок при добавлении концентрированных растворов солей. В лабораторных
условиях такие приёмы прекрасно работают, а от осадка исследователи
освобождаются, помещая пробирки, на несколько минут, в центрифугу. После
этого все более или менее крупные клеточные обломки, денатурированные
белки и другие примеси оказываются на дне, образуя очень плотный осадок,
и перелить в другую пробирку надосадочную жидкость, содержащую в
основном нуклеиновые кислоты — ДНК и РНК, — труда не составляет. Однако в
домашних условиях этот этап очистки нам придётся пропустить,
пожертвовав частью интересующего нас вещества, — оно так и останется „в
белковом плену".
Мы сразу же перейдём к очистке ДНК от остаточных
белков с помощью специальных ферментов, способных разрушать эти
молекулы. Именно такие вещества содержит сок ананаса. Сами они — тоже
белки, поэтому ананас, из которого выжимают сок, должен быть свежим: у
ферментов нет ни малейшего шанса сохраниться неизменными в компоте или в
консервированном продукте. Что же касается раствора для очистки линз,
то если вы собираетесь использовать его — не забудьте положить таблетку
для удаления белковых отложений! Сами по себе растворы для хранения
контактных линз никаких активных веществ не содержат — иначе и нашим
глазам не поздоровилось бы.
О том, что ферменты сработали, можно
судить по уменьшению вязкости раствора. Если этого не происходит,
поместите смесь в тёплое место (примерно 37°С) на полчаса, иногда может
потребоваться добавить больше ананасового сока или раствора для очистки
линз.
6. Осаждаем ДНК из раствора
Теперь ДНК плавает в растворе сама по
себе. Белки больше не цепляются за неё, хотя обломков всевозможных
молекул в смеси по-прежнему много. В лабораторных условиях эти ненужные
фрагменты убирают, тщательно перемешивая раствор с фенолом и/или
хлороформом. Органические растворители, способные забирать белки „на
себя", тяжелее воды, а потому при последующем расслоении смеси в
центрифуге они опускаются на дно. После центрифугирования внизу пробирки
оказываются фенол и/или хлороформ с растворёнными в них белками, а
вверху — водная фаза, содержащая ДНК. Водную фазу собирают в отдельную
пробирку и дальше работают уже с относительно чистым раствором.
За
неимением центрифуги и органических растворителей, работа с которыми
требует к тому же специальных мер безопасности, этот этап очистки в
домашних условиях приходится пропустить и осаждать ДНК прямо из
„грязного" раствора.
Заметим сразу — заменить этиловый спирт водкой
или духами нельзя: если концентрация спирта будет низкой и упадёт при
смешивании с водной фазой до 60- 65%, ДНК в кристаллическое состояние не
перейдёт. Отчасти, именно по этой причине, наливать спирт в пробирку с
ДНК-содержащей смесью следует осторожно, наслаивая его сверху. Тогда
нижние слои спирта частично смешаются с раствором ДНК, начнётся процесс
кристаллизации нуклеиновых кислот, и они всплывут на поверхность (где
спирт более концентрированный) в виде хлопьев.
Если же налить спирт
сверху не получится и всё безнадёжно перемешается, то при малом
количестве этанола у вас вообще ничего не получится, а при большом
начнёт кристаллизоваться не только ДНК: в осадок выпадут и остатки
белков, и кое-что ещё из исходного содержимого клеток.
7. Что же мы получили?
Чистые кристаллы ДНК похожи на клубки
спутанных нитей, но не надо забывать, что вы видите именно кристаллы
вещества, а не его макромолекулы, и сказать по их внешнему виду, какие
гены содержит выделенная вами нуклеиновая кислота, конечно, невозможно.
Чтобы узнать это, придётся снова растворять ДНК. Впрочем, „прочесть"
последовательность нуклеотидов в домашних условиях, увы, невозможно: для
этого нужны не только специальные приборы, но и дорогие реактивы.
Однако
если вы уже хорошо рассмотрели кристаллы и они успели подсохнуть,
можете понаблюдать за тем, как ДНК растворяется. Она в начале набухает,
становясь похожей на студенистую медузу, и лишь спустя несколько дней
раствор делается однородным. Процесс можно ускорить, если пробирку
почаще встряхивать .
Желаем успехов начинающим генетикам и молекулярным биологам!
|

